Travel Tips
Lorem ipsum dolor sit amet, consectetur adipiscing elit.
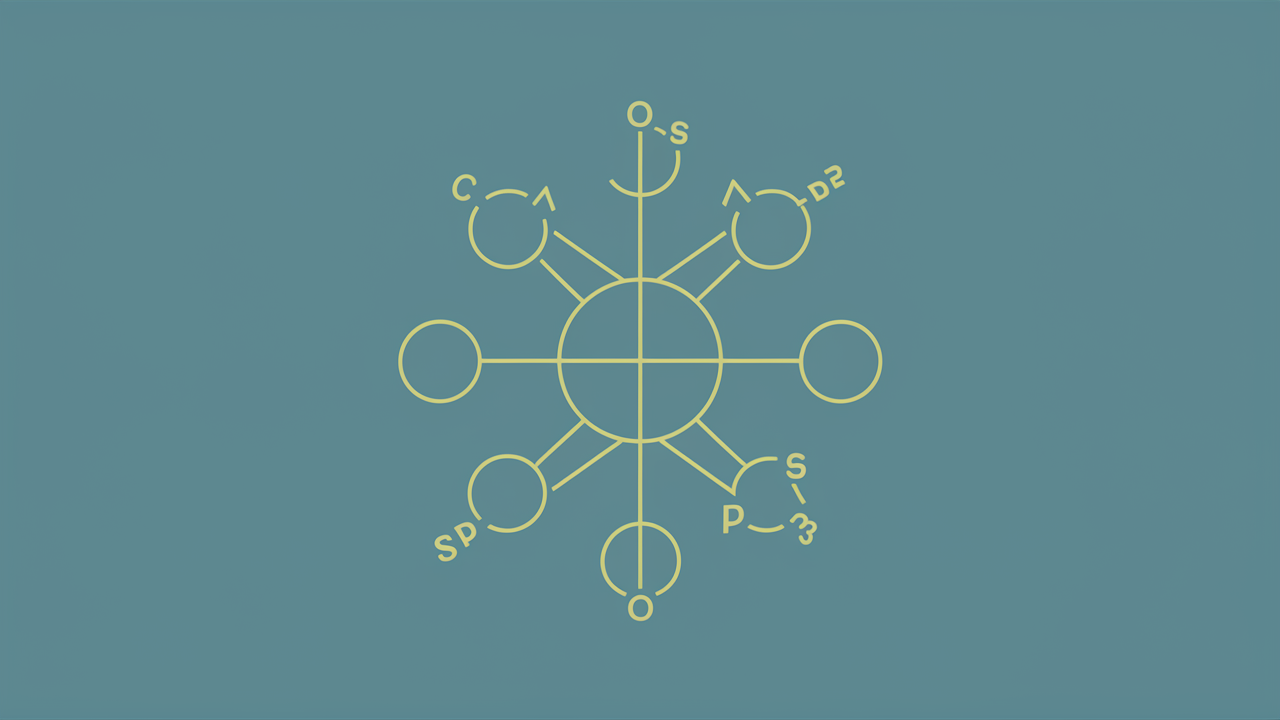
Explorando o conceito de hibridação orbital e suas implicações
A hibridação orbital é um conceito fundamental na química que descreve a combinação de orbitais atômicos para formar novos orbitais híbridos, os quais são utilizados para formar ligações químicas entre átomos. Esse fenômeno é essencial para entender a geometria molecular e a natureza das ligações em compostos químicos. A hibridação ajuda a explicar a distribuição de elétrons em moléculas, o que, por sua vez, influencia suas propriedades físicas e químicas.
Para compreender a hibridação orbital, é importante primeiro entender o que são os orbitais atômicos. Os orbitais são regiões do espaço onde a probabilidade de encontrar um elétron é alta. Os principais tipos de orbitais são s, p, d e f, cada um com suas características e formas específicas.
A hibridação ocorre quando esses orbitais se combinam, criando orbitais híbridos que têm energia e forma intermediárias. Os tipos mais comuns de hibridação incluem sp, sp² e sp³, cada um associado a diferentes geometrias moleculares.
A hibridação sp, por exemplo, ocorre quando um orbital s e um orbital p se combinam, resultando em dois orbitais híbridos.
Essa configuração é típica em moléculas lineares, como o etileno, onde a geometria é linear com um ângulo de ligação de 180 graus. Já a hibridação sp² envolve um orbital s e dois orbitais p, formando três orbitais híbridos que se dispõem em um plano, resultando em uma geometria trigonal planar, como observada no eteno. Por fim, a hibridação sp³ combina um orbital s e três orbitais p, gerando quatro orbitais híbridos que se organizam em uma geometria tetraédrica, como na molécula de metano.
Um aspecto interessante da hibridação orbital é a sua relação com a teoria da repulsão dos pares de elétrons da camada de valência (VSEPR). Essa teoria sugere que a forma de uma molécula é determinada pela repulsão entre os pares de elétrons ao redor do átomo central. A hibridação fornece uma explicação para essas formas, uma vez que a disposição dos orbitais híbridos minimiza a repulsão entre os elétrons, resultando em geometrias moleculares estáveis.
A hibridação também é crucial para entender a formação de ligações duplas e triplas. Em uma ligação dupla, como a encontrada no etileno, um par de elétrons é compartilhado em uma ligação sigma (σ), que resulta da sobreposição de orbitais híbridos, enquanto a outra ligação é uma ligação pi (π), que surge da sobreposição lateral de orbitais p não hibridizados. Em ligações triplas, como a do acetileno, uma combinação semelhante ocorre, envolvendo uma ligação sigma e duas ligações pi.
Historicamente, o conceito de hibridação orbital foi desenvolvido na década de 1930 por Linus Pauling, que buscava explicar a estrutura das moléculas de forma mais intuitiva. Desde então, a hibridação tem sido uma ferramenta poderosa na química, permitindo a previsão das propriedades das moléculas e suas reações. Pauling também introduziu o conceito de eletronegatividade, que, em conjunto com a hibridação, ajuda a entender a polaridade das ligações.
A aplicação da hibridação orbital não se limita apenas à química orgânica; ela é relevante em diversas áreas, como a química inorgânica e a bioquímica. Por exemplo, a estrutura do DNA e as interações entre proteínas são influenciadas pela hibridação dos átomos que as compõem. A compreensão da hibridação é, portanto, essencial para o avanço do conhecimento em várias disciplinas científicas.
Em conclusão, a hibridação orbital é um conceito central na química que fornece uma base sólida para entender como os átomos se ligam e formam moléculas. Ao combinar diferentes orbitais atômicos, a hibridação explica a geometria molecular e a natureza das ligações químicas, permitindo que os cientistas prevejam comportamentos e reações químicas. Para aqueles que desejam aprofundar seu conhecimento, recomenda-se a leitura de obras clássicas de química, como "The Nature of the Chemical Bond" de Linus Pauling, que explora esses conceitos de maneira detalhada.